肺移植は進行肺疾患に対する標準的な治療法です。過去数十年にわたり、肺移植は、移植患者のスクリーニングと評価、ドナー肺の選択、保存、割り当て、手術技術、術後管理、合併症管理、免疫抑制において目覚ましい進歩を遂げてきました。
60年以上にわたり、肺移植は実験的な治療法から、生命を脅かす肺疾患に対する標準的な治療法として認められるようになりました。移植片機能不全、慢性移植肺機能不全(CLAD)、日和見感染症のリスク増加、癌、免疫抑制に関連する慢性的な健康問題といった一般的な問題を抱えながらも、適切なレシピエントを選択することで、患者の生存率と生活の質を向上させることが期待されています。肺移植は世界中で普及しつつありますが、手術件数は依然として増加する需要に追いついていません。本レビューでは、肺移植の現状と最近の進歩、そして困難ではあるものの人生を変える可能性を秘めたこの治療法を効果的に実施するための将来の可能性に焦点を当てます。
潜在的な受給者の評価と選定
適切なドナーの肺は比較的不足しているため、移植センターは倫理的に、移植から純利益を得る可能性が最も高い潜在的なレシピエントにドナー臓器を割り当てる必要があります。このような潜在的なレシピエントの従来の定義は、移植された肺が完全に機能すると仮定した場合、2年以内に肺疾患で死亡するリスクが50%以上、移植後5年生存する確率が80%以上と推定されることです。肺移植の最も一般的な適応症は、肺線維症、慢性閉塞性肺疾患、肺血管疾患、および嚢胞性線維症です。患者は、肺機能の低下、身体機能の低下、および薬物療法と外科療法を最大限に活用したにもかかわらず病気が進行していることに基づいて紹介されます。その他の疾患固有の基準も考慮されます。予後に関する課題は、情報に基づいた共同意思決定を改善し、移植の成功を阻む潜在的な障壁を変える機会を向上させるための、より適切なリスクとベネフィットのカウンセリングを可能にする早期紹介戦略をサポートします。多職種チームが肺移植の必要性と、免疫抑制剤の使用による移植後合併症(生命を脅かす可能性のある感染症など)のリスクを評価します。肺外臓器機能障害、体力、精神状態、全身免疫、がんのスクリーニングは不可欠です。冠動脈および脳動脈、腎機能、骨の健康、食道機能、心理社会的能力、社会的支援に関する具体的な評価も不可欠です。移植の適格性を判断する際に不公平が生じないよう、透明性を維持するよう配慮します。
複数の危険因子は、単一の危険因子よりも有害です。移植に対する従来の障壁には、高齢、肥満、がんの病歴、重篤な疾患、および併発する全身性疾患などがありますが、これらの要因は最近になって疑問視されています。レシピエントの年齢は着実に上昇しており、2021年までには米国のレシピエントの34%が65歳以上になり、実年齢よりも生物学的年齢が重視されるようになると予測されます。現在では、6分間歩行距離に加えて、身体的予備力やストレス要因への予想される反応に焦点を当てた、より正式な虚弱性評価が行われることがよくあります。虚弱性は肺移植後の転帰不良と関連しており、通常は体組成と関連しています。肥満と体組成を計算する方法は進化を続けており、BMIよりも脂肪含有量と筋肉量に重点を置いています。肺移植後の回復能力をより正確に予測するために、虚弱性、筋萎縮、回復力を定量化するツールが開発されています。術前の肺リハビリテーションにより、体組成と衰弱を修正し、結果を改善することが可能です。
急性重篤疾患の場合、衰弱の程度と回復能力を判断することは特に困難です。人工呼吸器を装着している患者における移植は、以前はまれでしたが、現在では一般的になりつつあります。さらに、近年、移植前の移行治療として体外生命維持装置(European Life Support:ELS)の使用が増加しています。技術と血管アクセスの進歩により、慎重に選ばれた意識のある患者が体外生命維持装置(ELS)を受けることで、インフォームド・コンセント手続きや身体リハビリテーションに参加し、移植前にELSを必要としなかった患者と同等の転帰を移植後に得ることが可能になりました。
全身性の併発疾患は以前は絶対的禁忌と考えられていましたが、現在では移植後の転帰への影響を具体的に評価する必要があります。移植に関連する免疫抑制は癌の再発の可能性を高めるため、既存の悪性腫瘍に関する以前のガイドラインでは、移植待機リストに登録される前に患者が5年間癌に罹患していないことという要件を強調していました。しかし、癌治療がより効果的になるにつれて、現在では患者ごとに癌の再発の可能性を評価することが推奨されています。全身性自己免疫疾患は伝統的に禁忌と考えられてきましたが、進行した肺疾患はそのような患者の平均余命を制限する傾向があるため、この見解には問題があります。新しいガイドラインでは、強皮症に関連する食道の問題など、転帰に悪影響を与える可能性のある疾患の兆候を減らすために、肺移植に先立って、より的を絞った疾患の評価と治療を行うべきであると推奨されています。
特定のHLAサブクラスに対する循環抗体は、一部のレシピエント候補に特定のドナー臓器に対するアレルギーを引き起こす可能性があり、その結果、待機期間の延長、移植の可能性の低下、急性臓器拒絶反応、およびCLAD(慢性副腎皮質障害)のリスク上昇につながります。しかしながら、候補レシピエント抗体とドナータイプ間の移植では、血漿交換、静注免疫グロブリン、抗B細胞療法などの術前脱感作療法により、同様の結果が得られた例もあります。
ドナー肺の選択と適用
臓器提供は利他的な行為です。ドナーの同意を得て、その自律性を尊重することが、最も重要な倫理的要素です。ドナーの肺は、胸部外傷、心肺蘇生、誤嚥、塞栓症、人工呼吸器関連の損傷や感染症、神経性損傷などによって損傷を受ける可能性があり、移植に適さないドナーの肺も少なくありません。ISHLT(国際心肺移植学会)
肺移植では、一般的に受け入れられているドナー基準を定義していますが、これは移植センターごとに異なります。実際、肺提供の「理想的な」基準を満たすドナーはごくわずかです(図 2)。ドナー基準の緩和(従来の理想的な基準を満たさないドナーなど)、慎重な評価、積極的なドナーケア、および in vitro 評価によって、ドナー肺の利用率が向上しました(図 2)。ドナーの喫煙歴は、レシピエントにおける一次性移植機能不全の危険因子ですが、そのような臓器の使用による死亡リスクは限られており、非喫煙者からのドナー肺を長期間待つことで生じる死亡率の結果と比較検討する必要があります。厳格に選択され、他の危険因子がない高齢(70 歳以上)ドナーの肺を使用することで、若年ドナーの場合と同等のレシピエントの生存率および肺機能の結果を達成できます。
複数の臓器提供者に対する適切なケアと肺の提供の可能性の検討は、ドナーの肺が移植に適している可能性を高めるために不可欠です。現在提供されている肺のうち、理想的なドナー肺の従来の定義を満たすものはほとんどありませんが、これらの従来の基準を超えて基準を緩和することで、転帰を損なうことなく臓器を有効活用できる可能性があります。標準化された肺保存方法は、レシピエントに移植される前に臓器の完全性を保護するのに役立ちます。臓器は、凍結保存、低体温または常温での機械的灌流など、様々な条件下で移植施設に輸送されます。即時移植に適さないと判断された肺は、さらに客観的に評価され、体外肺灌流(EVLP)で治療したり、移植に対する組織的な障壁を克服するために長期間保存したりする場合があります。肺移植の種類、手順、術中サポートはすべて、患者のニーズと外科医の経験と好みによって異なります。移植を待つ間に病状が劇的に悪化した肺移植候補者の場合、移植前の移行治療として体外生命維持装置が考慮されることがあります。術後の早期合併症には、出血、気道閉塞、血管吻合部閉塞、創傷感染などがあります。胸部の横隔膜神経や迷走神経の損傷は他の合併症を引き起こし、それぞれ横隔膜機能や胃内容排出に影響を及ぼします。ドナーの肺は、移植および再灌流後に早期の急性肺障害、すなわち一次性移植片機能不全を起こすことがあります。早期死亡の高リスクに関連する一次性移植片機能不全の重症度を分類し治療することは重要です。ドナーの肺の損傷は最初の脳損傷から数時間以内に起こるため、肺の管理には適切な換気設定、肺胞再拡張、気管支鏡検査および吸引・洗浄(培養検体の採取のため)、患者の体液管理、胸部位置の調整を含める必要があります。 ABOはA、B、AB、O型の血液型、CVPは中心静脈圧、DCDは心臓死からの肺提供、ECMOは体外膜型人工肺、EVLWは血管外肺水、PaO2/FiO2は動脈血酸素分圧と吸入酸素濃度の比、PEEPは呼気終末陽圧を表します。PiCCOは脈拍指数波形の心拍出量を表します。
一部の国では、心臓死の患者における制御肺(DCD)の使用が30~40%に上昇しており、急性臓器拒絶反応、CLAD、生存率も同様に達成されています。伝統的に、感染性ウイルスに感染したドナーからの臓器を、未感染のレシピエントに移植することは避けるべきです。しかし近年、C型肝炎ウイルス(HCV)に直接作用する抗ウイルス薬により、HCV陽性ドナーの肺をHCV陰性レシピエントに安全に移植することが可能になりました。同様に、ヒト免疫不全ウイルス(HIV)陽性ドナーの肺はHIV陽性レシピエントに移植でき、B型肝炎ウイルス(HBV)陽性ドナーの肺はHBVワクチン接種を受けたレシピエントや免疫のあるレシピエントに移植できます。SARS-CoV-2に感染した活動性または過去の感染歴のあるドナーからの肺移植の報告があります。移植のためにドナーの肺を感染性ウイルスで感染させることの安全性を判断するには、さらなる証拠が必要です。
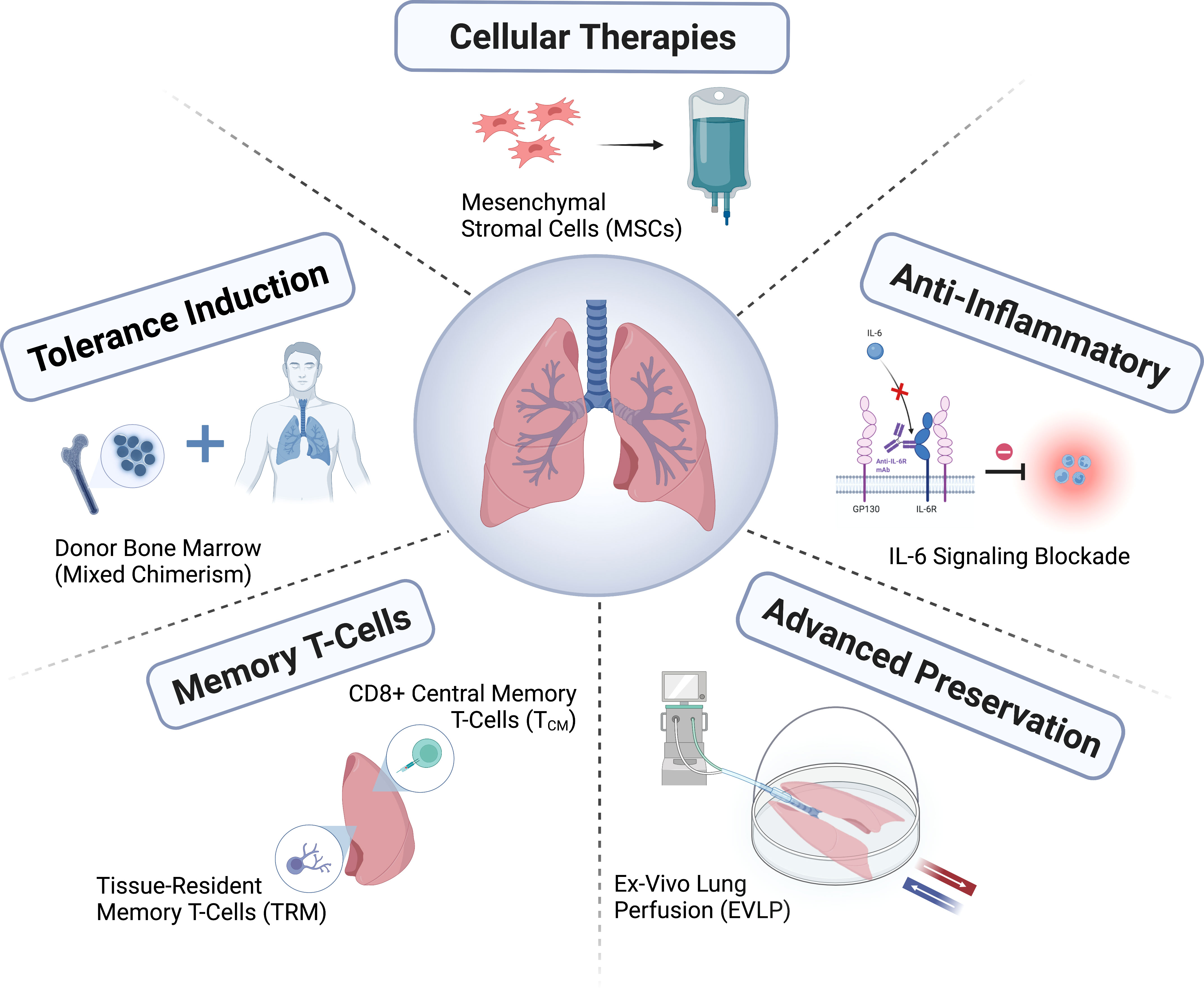
複数の臓器を採取する作業は複雑なため、ドナーの肺の品質を評価することは困難です。in vitro 肺灌流システムを用いて評価することで、ドナーの肺の機能を詳細に評価し、使用前に修復できる可能性を高めることができます(図 2)。ドナーの肺は損傷を受けやすいため、in vitro 肺灌流システムは、損傷したドナーの肺を修復するための特定の生物学的療法を投与するためのプラットフォームを提供します(図 2)。2 件のランダム化試験により、従来の基準を満たすドナーの肺を in vitro で常温肺灌流することは安全であり、移植チームはこの方法で保存時間を延長できることが示されています。ドナーの肺を氷上で 0 ~ 4 °C ではなく、より高い低体温(6 ~ 10 °C)で保存すると、ミトコンドリアの健康状態が改善され、損傷が軽減され、肺機能が改善することが報告されています。半選択的日帰り移植の場合、より長い一晩保存によって移植後の転帰が良好になることが報告されています。現在、10℃での保存と標準的な凍結保存を比較する大規模な非劣性安全性試験が進行中です(ClinicalTrials.govの登録番号NCT05898776)。移植に質の高い臓器を使用できるよう、多臓器ドナーケアセンターを通じた迅速な臓器回収や、臓器修復センターを通じた臓器機能の改善を推進する動きが高まっています。移植エコシステムにおけるこれらの変化の影響は、現在も評価中です。
制御可能なDCD臓器を温存するために、体外式膜型人工肺(ECMO)を用いた常温局所灌流は、腹部臓器の機能評価や、肺を含む胸部臓器の直接採取・保存に有用です。胸部および腹部における常温局所灌流後の肺移植経験は限られており、結果は様々です。この処置は、死体ドナーに損傷を与え、臓器摘出の基本倫理原則に違反する可能性があるという懸念があるため、多くの国では常温局所灌流はまだ許可されていません。
癌
肺移植後の人口における癌の発生率は一般人口よりも高く、予後は不良である傾向があり、死亡者の 17% を占めています。肺癌と移植後リンパ増殖性疾患 (PTLD) は、癌関連死の最も一般的な原因です。長期の免疫抑制、以前の喫煙の影響、または基礎にある肺疾患のリスクはすべて、片方の肺のレシピエント自身の肺に肺癌を発症するリスクにつながりますが、まれに、ドナーから伝達された無症状の肺癌が移植された肺に発生することもあります。非黒色腫皮膚癌は移植レシピエントに最も多く見られる癌であるため、定期的な皮膚癌のモニタリングが不可欠です。エプスタイン・バーウイルスによって引き起こされる B 細胞 PTLD は、疾患および死亡の重要な原因です。PTLD は最小限の免疫抑制で解消できますが、リツキシマブ、全身化学療法、またはその両方による B 細胞標的療法が通常は必要です。
生存率と長期転帰
肺移植後の生存期間は他の臓器移植に比べて短く、中央値は6.7年です。患者の長期転帰は30年以上にわたってほとんど改善が見られません。しかし、多くの患者で生活の質、身体状態、その他の患者報告転帰が大幅に改善しました。肺移植の治療効果をより包括的に評価するには、これらの患者が報告する転帰にもっと注意を払う必要があります。重要なアンメット臨床ニーズとして、移植不全の遅延や長期の免疫抑制などの致命的な合併症によるレシピエントの死亡に対処することが挙げられます。肺移植のレシピエントには、移植片機能をモニタリング・維持しながら、免疫抑制の副作用を最小限に抑え、レシピエントの心身の健康をサポートすることで、レシピエントの全体的な健康を守るためのチームワークを必要とする積極的な長期ケアを行う必要があります(図1)。
今後の方向性
肺移植は短期間で大きな進歩を遂げた治療法ですが、その潜在能力はまだ十分に発揮されていません。適切なドナー肺の不足は依然として大きな課題であり、ドナーの評価とケア、ドナー肺の治療と修復、そしてドナー肺の保存性向上のための新たな方法の開発が進められています。純利益をさらに高めるためには、ドナーとレシピエントのマッチングを改善することで、臓器分配政策を改善する必要があります。特にドナー由来遊離DNAを用いた分子診断による拒絶反応や感染症の診断、あるいは免疫抑制の最小化への道筋への関心が高まっています。しかしながら、これらの診断法が現在の臨床移植モニタリング法の補助としてどれほど有用であるかは、まだ十分に解明されていません。
肺移植分野は、コンソーシアム(例:ClinicalTrials.gov 登録番号 NCT04787822、https://lungtransplantconsortium.org)の形成を通じて発展してきました。これらの連携は、一次移植片機能不全の予防と治療、CLAD予測、早期診断と内部ポイント(エンドタイピング)、症候群の精緻化に役立ちます。一次移植片機能不全、抗体介在性拒絶反応、ALADおよびCLADのメカニズムの研究は急速に進歩しています。個別化免疫抑制療法を通じて副作用を最小限に抑え、ALADおよびCLADのリスクを低減するとともに、患者中心のアウトカムを定義し、アウトカム指標に組み込むことが、肺移植の長期的な成功率を向上させる鍵となります。
投稿日時: 2024年11月23日