院内肺炎は最も一般的かつ深刻な院内感染症であり、そのうち人工呼吸器関連肺炎(VAP)は40%を占めています。難治性病原体によって引き起こされるVAPは、依然として難しい臨床問題です。長年にわたり、ガイドラインではVAPの予防のために様々な介入(標的鎮静、頭部挙上など)が推奨されてきましたが、気管挿管を受けた患者の最大40%にVAPが発生し、入院期間の延長、抗生物質の使用量の増加、そして死亡につながっています。人々は常に、より効果的な予防策を模索しています。
人工呼吸器関連肺炎(VAP)は、気管挿管後48時間以内に発症する新規肺炎であり、集中治療室(ICU)における最も一般的かつ致死的な院内感染です。2016年の米国感染症学会ガイドラインでは、VAPと院内肺炎(HAP)の定義が区別されています(HAPは気管チューブを装着せずに入院後に発症し、機械的人工呼吸器に関連しない肺炎のみを指し、VAPは気管挿管と機械的人工呼吸器の併用後に発症する肺炎を指します)。欧州感染症学会および中国では、VAPは依然としてHAPの特殊な型であると考えられています[1-3]。
人工呼吸器を装着している患者におけるVAPの発生率は9%から27%、死亡率は13%と推定されており、全身的抗菌薬使用量の増加、人工呼吸器の長期化、ICU在室期間の延長、およびコストの増大につながる可能性がある[4-6]。免疫不全ではない患者のHAP/VAPは、通常、細菌感染が原因であり、一般的な病原体の分布と耐性特徴は、地域、病院のクラス、患者集団、および抗菌薬への曝露によって異なり、時間の経過とともに変化する。欧米では緑膿菌がVAP関連の病原体の大部分を占めていたが、中国の三次医療機関ではアシネトバクター・バウマニがより多く分離された。VAP関連の死亡例の3分の1から半分は直接感染が原因であり、緑膿菌とアシネトバクターが原因の症例の死亡率はより高くなっている[7,8]。
VAPは異質性が非常に高いため、臨床症状、画像検査、臨床検査の診断特異性が低く、鑑別診断の範囲が広く、早期診断が困難です。同時に、細菌耐性はVAPの治療において深刻な課題となっています。VAP発症リスクは、人工呼吸器使用開始後5日間は3%/日、5日目から10日目は2%/日、それ以降は1%/日と推定されています。発症率のピークは通常、人工呼吸器使用開始後7日目以降に発生するため、早期に感染を予防できる可能性があります[9,10]。 VAP の予防については多くの研究が行われていますが、数十年にわたる研究と VAP を予防する試み (挿管の回避、再挿管の防止、鎮静剤の減量、ベッドの頭側を 30 ~ 45 度上げる、口腔ケアなど) にもかかわらず、発生率は減少していないようで、関連する医療負担は依然として非常に高いままです。
吸入抗生物質は1940年代から慢性気道感染症の治療に使用されてきました。薬剤の感染部位(気道)への到達を最大限に高め、全身的な副作用を軽減できるため、様々な疾患において優れた応用価値を示しています。吸入抗生物質は現在、嚢胞性線維症の治療薬として米国食品医薬品局(FDA)および欧州医薬品庁(EMA)によって承認されています。吸入抗生物質は、全体的な有害事象を増加させることなく、気管支拡張症における細菌量と増悪頻度を大幅に低減できるため、現在のガイドラインでは、緑膿菌感染症および頻回の増悪を伴う患者に対する第一選択治療薬として認められています。肺移植の周術期における吸入抗生物質は、補助薬または予防薬としても使用できます[11,12]。しかし、2016年の米国VAPガイドラインでは、大規模なランダム化比較試験が不足しているため、専門家は補助的な吸入抗生物質の有効性に自信を持てませんでした。 2020年に発表された第3相試験(INHALE)でも、肯定的な結果は得られませんでした(VAP患者によるグラム陰性菌感染症に対するアミカシン吸入補助による静脈内抗生物質、二重盲検、ランダム化、プラセボ対照、第3相有効性試験、患者合計807名、全身薬物療法+アミカシン吸入補助を10日間)。
このような状況下、フランスのトゥール地域大学病院センター(CHRU)の研究者を中心とするチームは、異なる研究戦略を採用し、研究者主導多施設二重盲検ランダム化比較試験(AMIKINHAL)を実施しました。フランスの19のICUにおいて、VAP予防のための吸入アミカシンとプラセボを比較しました[13]。
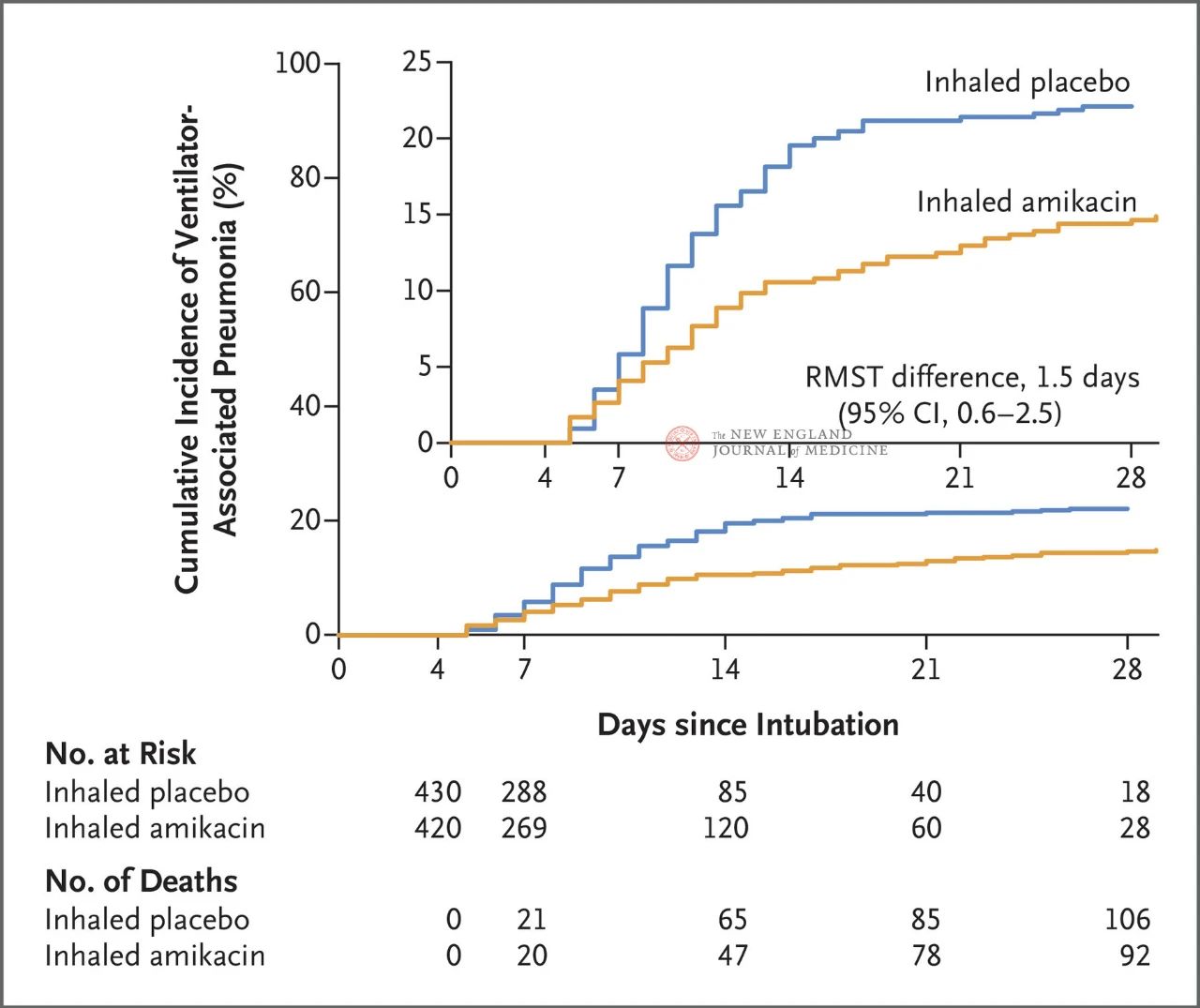
72時間から96時間の間に侵襲的人工呼吸器を装着した成人患者847名を、アミカシン吸入群(N=417、理想体重1kgあたり20mg、1日1回)またはプラセボ吸入群(N=430、塩化ナトリウム換算0.9%)に1:1の割合で無作為に割り付け、3日間投与した。主要評価項目は、無作為割付開始から28日目までのVAP初回発症とした。
試験の結果、28日目にアミカシン群の患者62名(15%)がVAPを発症し、プラセボ群の患者95名(22%)がVAPを発症した(VAPの限定平均生存差は1.5日、95% CI、0.6〜2.5、P=0.004)。
安全性に関しては、アミカシン群で7例(1.7%)、プラセボ群で4例(0.9%)が試験関連の重篤な有害事象を発現した。無作為化時に急性腎障害を発現していなかった被験者のうち、アミカシン群で11例(4%)、プラセボ群で24例(8%)が28日目に急性腎障害を発現した(HR 0.47、95% CI 0.23~0.96)。
この臨床試験には3つのハイライトがありました。まず、研究デザインの観点から、AMIKINHAL試験はIASIS試験(143名の患者を対象としたランダム化二重盲検プラセボ対照並行第2相試験)を参考にしています。アミカシン-ホスホマイシン吸入全身療法の安全性と有効性を評価するために、VAP(Variable Perspective:呼吸筋麻痺)によるグラム陰性菌感染症に対するINHALE試験が否定的な結果に終わったことを踏まえ、VAPの予防に重点を置き、比較的良好な結果を得ました。人工呼吸器とVAPを患う患者は死亡率が高く、入院期間が長いという特徴があるため、アミカシン吸入がこれらの患者の死亡率と入院期間を短縮する上で有意に異なる結果を達成できれば、臨床現場にとってより価値のあるものとなるでしょう。しかし、各患者および各施設における後期治療とケアの不均一性を考慮すると、研究を妨げる可能性のある交絡因子が多数存在し、吸入抗生物質に起因する肯定的な結果を得ることも難しい可能性があります。したがって、臨床研究を成功させるには、優れた研究設計だけでなく、適切な主要評価項目の選択も必要です。
第二に、アミノグリコシド系抗生物質は、様々なVAPガイドラインにおいて単剤薬として推奨されていないものの、VAP患者によく見られる病原体(緑膿菌、アシネトバクターなど)をカバーできること、肺上皮細胞への吸収が限られていること、感染部位における濃度が高いこと、全身毒性が低いことなどから、吸入抗生物質の中では広く支持されている。本論文は、以前に発表された少量サンプルにおけるゲンタマイシンの気管内投与の効果量の包括的な推定値と一致しており、これらを併せて吸入アミノグリコシド系抗生物質のVAP予防効果を実証している。また、吸入抗生物質に関する試験で選択されたプラセボ対照のほとんどが生理食塩水であることにも留意すべきである。しかし、生理食塩水の霧状吸入自体が痰を薄めて去痰作用を助ける一定の役割を果たすことを考慮すると、生理食塩水は研究結果の分析に一定の妨害を引き起こす可能性があり、研究ではこれを総合的に考慮する必要があります。
さらに、HAP/VAP治療薬の地域適応は重要であり、抗生物質予防も重要です。同時に、挿管時間の長さに関わらず、地域のICUの生態は多剤耐性菌感染の最も重要なリスク要因です。したがって、経験的治療では、可能な限り地域の病院の微生物学データを参照する必要があり、ガイドラインや三次病院の経験を盲目的に参照することはできません。同時に、機械的人工呼吸器を必要とする重症患者は、多臓器疾患を合併していることが多く、ストレス状態などの複数の因子の複合作用により、腸内細菌叢が肺にクロストークする現象も発生する可能性があります。内外の重なりによって引き起こされる疾患の異質性の高さも、それぞれの新しい介入の大規模な臨床推進が長い道のりであることを決定づけています。
投稿日時: 2023年12月2日